AG Molekulare Physiologie

Chitin ist ein weit verbreitetes Polymer aus N-Acetylglucosamin-Einheiten, das für die chemisch/pharmazeutische Industrie zunehmend an Bedeutung gewinnt. In der Natur findet sich dieses faserartige Molekül unter anderem in den Zellwänden von Pilzen und in mechanisch widerstandsfähigen Bioverbundstoffen wie den Panzern von Krebstieren und Insekten. Chitin lässt sich aber auch in der peritrophischen Matrix nachweisen, einer schleimartigen Pseudomembran im Verdauungstrakt von Invertebraten. Unsere Arbeitsgruppe beschäftigt sich mit dem Metabolismus von Chitin bei Pilzen und Insekten. Dabei untersuchen wir mit molekularbiologischen und biochemischen Methoden die verschiedenen Proteine, die für die Biosynthese, Modifizierung und Degradation von Chitin benötigt werden. Daneben interessieren wir uns für die Wirkmechanismen von Inhibitoren der Chitinsynthese, die als Fungizide und Insektizide breite Verwendung finden.
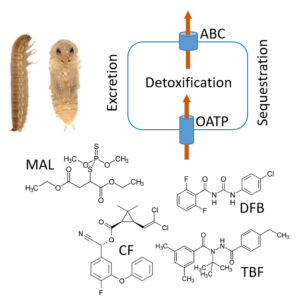
Ein zentrales Enzym im Chitin-Metabolismus von Pilzen und Insekten ist die Chitinsynthase, eine membrangebundene Glycosyltransferase, welche die Zucker-Polymerisation katalysiert. Nachdem wir die Chitinsynthase erstmalig aus dem Mitteldarm von Insekten biochemisch gereinigt und charakterisiert haben, untersuchen wir nun sowohl ihre Struktur als auch die Regulation ihrer Aktivität, die sich jedoch nicht vollends verstehen lässt, ohne intrazelluläre Prozesse zu berücksichtigen. Deswegen analysieren wir die Prozessierung und Sortierung relevanter Proteine auch in dem zellbiologischen Modellorganismus Saccharomyces cerevisiae, die Bäckerhefe, die Chitin für ihre Zellwand synthetisiert. Die Chitinsynthese ist ferner ein Angriffspunkt für Fungizide und Insektizide, die im Pflanzenschutz oder bei der Behandlung von Infektionskrankheiten eingesetzt werden können. Wir untersuchen dabei vor allem die Gruppe der Benzoylphenyl-Harnstoffe, da bislang nicht bekannt ist, wie diese seit langem eingesetzten Insektizide die Chitinsynthese hemmen. Der rostbraune Mehlkäfer, Tribolium castaneum, dessen Genom komplett sequenziert ist, dient uns dabei als Modellsystem, wobei wir genomische und proteomische Untersuchungsansätze verfolgen. Potenzielle Zielgene lassen sich in diesem Organismus zudem über RNA-Interferenz ausschalten, was die Analyse erheblich vereinfacht. Dies nutzen wir unter anderem auch dazu die Funktion der peritrophischen Matrix, die als eine Infektionsbarriere im Insektendarm fungiert und wichtige Funktionen bei der Kompartimentalisierung der Verdaaung besitz, zu untersuchen. Weitere Forschungsschwerpunkte in unserer Arbeitsgruppe sind Chymotrypsin-ähnliche Serinproteasen sowie ABC-Transporter, die in die Elimination von Insekten und ihrer Metabolite involviert sind, und somit zu Insektizidresistenzen beitragen.
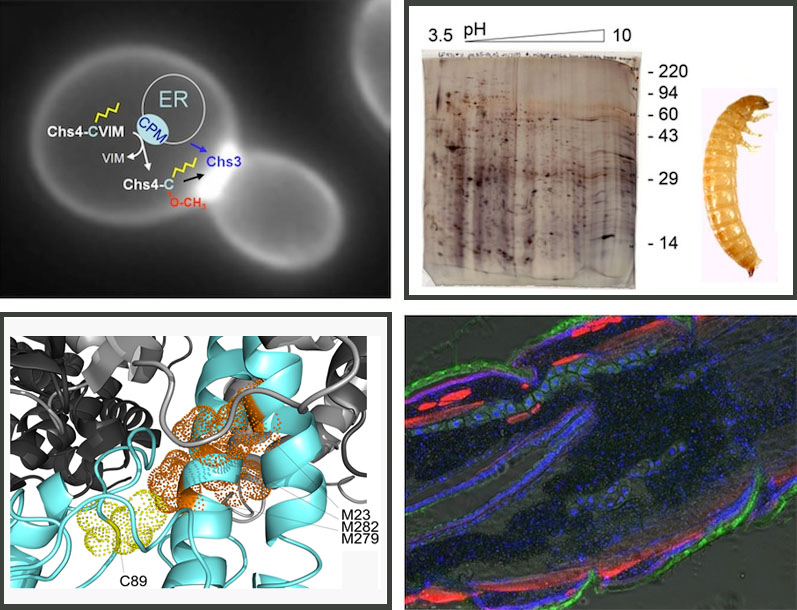
(A) In der Abbildung ist eine knospende Hefezelle gezeigt, wobei die intrazelluläre Lokalisation einer Chitinsynthase (Chs3) mit Hilfe des grün-fluoreszierenden Proteins sichtbar gemacht wurde. Für ihre Aktivität am Knospenhals wird die regulatorische Untereinheit Chs4 benötigt, die über CaaX-Prozessierung modifiziert wird. (B) 2D-Gelektrophorese von Proteinen aus dem larvalen Mitteldarm von Tribolium castaneum. Das 2D-Gel entstammt einer Untersuchung zur Veränderung des Mitteldarm-Proteoms nach Behandlung einem Insektizid aus der Gruppe der Benzoylphenyl-Harnstoffe. (C) Homologie-basiertes Strukturmodell einer Chymotrypsin-ähnlichen Protease aus der Häutungsflüssigkeit von Tribolium castaneum. Das aktive Zentrum ist blau, die Spezifitätstasche rot, ein Oberflächen-Loop orange und eine Glycosylierungsstelle (Pfeil) grün eingefärbt. Wir stellen diese Proteine rekombinant in Insektenzellen her, was uns ermöglicht ihre Spezifität nach ortsgerichteter Mutagenese zu analysieren. (D) Gefrierschnitt durch eine Tribolium-Larve. Die fixierten Schnitte wurden mit fluoreszierenden Farbstoffen gefärbt, um Zellkerne (blau), Aktinfilamente (rot) und Chitin-haltige Strukturen (grün) darzustellen.